萤火虫萤光素酶(Firefly luciferase)是一种分子量约为61 kDa的蛋白,在ATP、镁离子和氧气存在的条件下,能够催化萤光素(luciferin)氧化成oxyluciferin,在氧化的过程中会发出波长为560 nm左右的生物萤光。海肾萤光素酶(Renilla luciferase)是一种分子量约为36 kDa的蛋白,在氧气存在的条件下,可以催化腔肠素(coelenterazine)氧化成coelenteramide,在氧化的过程中会发出波长为480nm左右的生物萤光。两种生物萤光都可通过化学发光仪进行测定。检测原理如图所示:
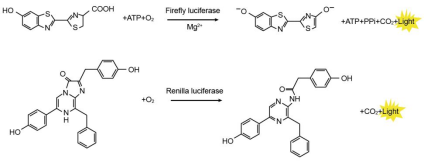
图1:萤火虫和海肾萤光素酶检测原理图
通常将目的基因的5´UTR或启动子克隆至Firefly Luciferase的上游,或3´UTR克隆至Firefly Luciferase的下游,通过检测萤火虫萤光素酶的量来检测启动子或调控元件的转录调控作用。Renilla Luciferase作为内参,来消除细胞数量、转染效率等的差异。Dual Luciferase Reporter Gene Assay Kit首先以萤光素为底物来检测萤火虫萤光素酶报告基因的活性,之后在淬灭该萤光反应的同时,以腔肠素为底物检测海肾萤光素酶报告基因的活性。该试剂盒具有灵敏度高的特点。
裂解能力更强:能够彻底裂解绝大部分种类细胞。
信号更强:能够精准检测弱启动子的表达。
线性范围更广:线性检测范围超过酶浓度的8个数量级。
1、产品性能和进口产品一致
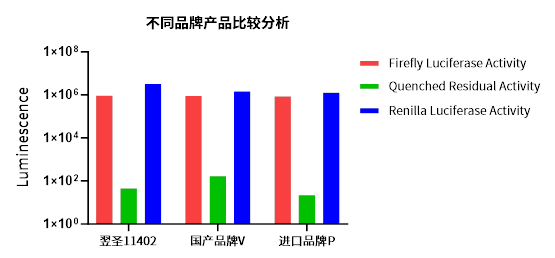
图1展示了萤火虫萤光素酶发光强度、淬灭效果以及海肾萤光素酶发光强度的对比情况。太阳成集团11402双荧光素酶报告基因检测产品在发光强度方面与进口品牌P表现相当。同时,在萤火虫萤光素酶的淬灭效果上,太阳成集团11402同样与进口品牌P不相上下,且显著优于其他国产品牌。此外,太阳成集团11402的荧光残留量极低,几乎可以忽略不计,这使得其完全不会对海肾萤光素酶的再次发光产生任何影响,从而保证了实验结果的准确性和可靠性。
2、信号更加稳定
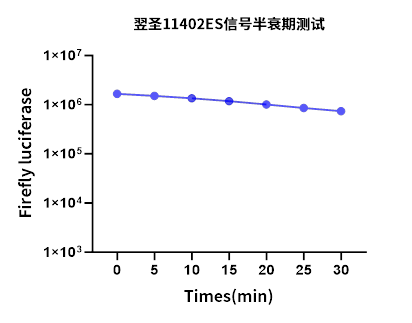
图2 太阳成集团11402双荧光素酶报告基因检测产品Firefly luciferase萤光信号稳定性(动力学)检测结果显示,从反应初始时刻起持续追踪Firefly luciferase萤光信号长达30分钟,发现太阳成集团11402的萤光信号几乎无衰减,信号稳定性表现出色,远超常规机器操作所需时长,能够充分满足实际检测需求。
3、冻融5次对产品信号基本无影响
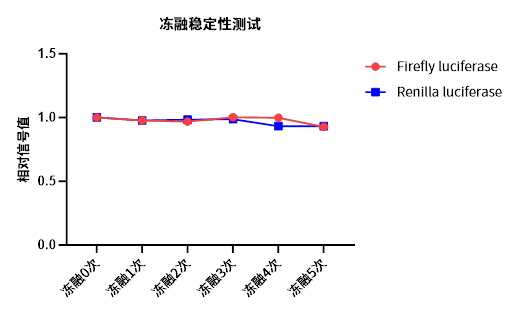
图3 太阳成集团11402双荧光素酶报告基因检测产品在经过5次反复冻融处理后,检测其Firefly luciferase和Renilla luciferase萤光信号,结果显示信号强度几乎不受影响,稳定性极高。这一特性使其在实验室环境中更具实用性,能够更好地满足日常使用需求。
干冰运输。 -20℃保存,有效期1年。
萤火虫萤光素酶反应工作液和海肾萤光素酶反应工作液现配现用,且不能反复冻融,建议分装-20℃或-80℃分装保存。
[1] Wang Z, Lu Z, Lin S, et al. Leucine-tRNA-synthase-2-expressing B cells contribute to colorectal cancer immunoevasion. Immunity. 2022;55(6):1067-1081.e8. doi:10.1016/j.immuni.2022.04.017(IF:43.474)
[2] Chen Y, Lu Z, Qi C, et al. N6-methyladenosine-modified TRAF1 promotes sunitinib resistance by regulating apoptosis and angiogenesis in a METTL14-dependent manner in renal cell carcinoma. Mol Cancer. 2022;21(1):111. Published 2022 May 10. doi:10.1186/s12943-022-01549-1(IF:27.401)
[3] Yao J, Wu D, Zhang C, et al. Macrophage IRX3 promotes diet-induced obesity and metabolic inflammation. Nat Immunol. 2021;22(10):1268-1279. doi:10.1038/s41590-021-01023-y(IF:25.606)
[4] Sun B, Yang X, Hou F, et al. Regulation of host and virus genes by neuronal miR-138 favours herpes simplex virus 1 latency. Nat Microbiol. 2021;6(5):682-696. doi:10.1038/s41564-020-00860-1(IF:17.745)
[5] Tian WH, Ye JY, Cui MQ, et al. A transcription factor STOP1-centered pathway coordinates ammonium and phosphate acquisition in Arabidopsis. Mol Plant. 2021;14(9):1554-1568. doi:10.1016/j.molp.2021.06.024(IF:13.164)
[6] Qiao J, Jiang H, Lin Y, et al. A novel miR167a-OsARF6-OsAUX3 module regulates grain length and weight in rice. Mol Plant. 2021;14(10):1683-1698. doi:10.1016/j.molp.2021.06.023(IF:13.164)
[7] Wang Y, Wang Z, Shao C, et al. Melatonin may suppress lung adenocarcinoma progression via regulation of the circular noncoding RNA hsa_circ_0017109/miR-135b-3p/TOX3 axis [published online ahead of print, 2022 Jun 4]. J Pineal Res. 2022;e12813. doi:10.1111/jpi.12813(IF:13.007)
[8] Chen H, Moreno-Moral A, Pesce F, et al. WWP2 regulates pathological cardiac fibrosis by modulating SMAD2 signaling [published correction appears in Nat Commun. 2019 Sep 9;10(1):4085]. Nat Commun. 2019;10(1):3616. Published 2019 Aug 9. doi:10.1038/s41467-019-11551-9(IF:11.878)
[9] Xiang X, Fu Y, Zhao K, et al. Cellular senescence in hepatocellular carcinoma induced by a long non-coding RNA-encoded peptide PINT87aa by blocking FOXM1-mediated PHB2. Theranostics. 2021;11(10):4929-4944. Published 2021 Mar 4. doi:10.7150/thno.55672(IF:11.556)
[10] Xu Y, Jiang Y, Wang Y, et al. LINC00473-modified bone marrow mesenchymal stem cells incorporated thermosensitive PLGA hydrogel transplantation for steroid-induced osteonecrosis of femoral head: A detailed mechanistic study and validity evaluation. Bioeng Transl Med. 2021;7(2):e10275. Published 2021 Dec 8. doi:10.1002/btm2.10275(IF:10.711)
[11] Huang X, He M, Huang S, et al. Circular RNA circERBB2 promotes gallbladder cancer progression by regulating PA2G4-dependent rDNA transcription [published correction appears in Mol Cancer. 2022 Jun 2;21(1):122]. Mol Cancer. 2019;18(1):166. Published 2019 Nov 21. doi:10.1186/s12943-019-1098-8(IF:10.679)
[12] Ma L, An R, Jiang L, et al. Effects of ZmHIPP on lead tolerance in maize seedlings: Novel ideas for soil bioremediation. J Hazard Mater. 2022;430:128457. doi:10.1016/j.jhazmat.2022.128457(IF:10.588)
[13] Xu C, Fan L, Lin Y, et al. Fusobacterium nucleatum promotes colorectal cancer metastasis through miR-1322/CCL20 axis and M2 polarization. Gut Microbes. 2021;13(1):1980347. doi:10.1080/19490976.2021.1980347(IF:10.245)
[14] Xiang Y, Bian X, Wei T, et al. ZmMPK5 phosphorylates ZmNAC49 to enhance oxidative stress tolerance in maize. New Phytol. 2021;232(6):2400-2417. doi:10.1111/nph.17761(IF:10.152)
[15] Gao Y, Li Z, Yang C, et al. Pseudomonas syringae activates ZAT18 to inhibit salicylic acid accumulation by repressing EDS1 transcription for bacterial infection. New Phytol. 2022;233(3):1274-1288. doi:10.1111/nph.17870(IF:10.152)





